核酸濃度檢測(二)——讀數解讀及注意事項
當我們獲得了Micro Drop超微量分光光度計檢測結果后,對光譜的正確分析至關重要。
輸出結果的含義:
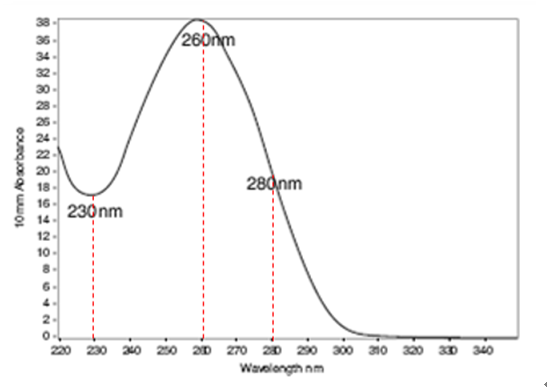
1. A260nm——核酸zui高吸收峰的吸收波長。
2. A280nm——蛋白zui高吸收峰的吸收波長。
3. A230nm——是碳水化合物zui高吸收峰的吸收波長。
4. A340nm——是基線校準波長,為檢測溶液樣品的濁度和其他干擾因子。該值應該接近0.0。如果不是,表明溶液中有懸浮物,需要純化樣品。純樣品的A340一般是0。
● A230產生負值主要是由于在很低 DNA 濃度的溶液中的一些其他成分的干擾所導致的。在下一個測定中,需要降低樣品的稀釋度,A230的負值會被校正。
● A260/A280比值可進行核酸樣品純度評估:純DNA的A260/A280比值為1.8,純 RNA的A260/A280比值為2.0。如果比值低,表示受到蛋白(芳香族)或酚類物質的污染,需要純化樣品。
● A260/A230比值可進行核酸樣品純度評估:純 DNA和RNA的A260/A230比值為 1.8 – 2.2。若比值小于1.8表明樣品被碳水化合物(糖類)、鹽類或有機溶劑污染,需要純化樣品。當 260/230<1 時,通常只有兩種情況。一是胍鹽污染,二是蛋白污染。
樣本的不同提取方法對檢測的影響:
● 苯酚/ Trizol萃取——殘留試劑污染可以通過220至240nm之間的異常光譜以及260至280nm區域的偏移來表示。
● 純化柱提取——殘留胍可能有助于230nm附近的峰值和從230nm到240nm的波谷偏移。
● 磁珠法提取——殘余珠可能會導致光散射,并導致異常光譜。
操作注意事項:
1. A260/A280、A260/A230比值受溶液酸堿度及離子強度的影響,如酸溶液會使A260/A280比值降低,低離子強度和低 pH 溶液會增加 280 nm 處的光吸收值。因此必須確保空白檢測和溶解樣品所用Buffer的離子濃度和pH值一致。
2. 濃度接近2 ng/μl濃度的樣品可能會導致不可靠的260/280和/或260/230的比值。
3. 樣品的稀釋濃度同樣是不可忽視的因素,由于樣品中不可避免存在一些細小的顆粒,尤其是核酸樣品。這些小顆粒的存在會干擾測試效果。樣品的濃度不能過低,或者過高(超過光度計的測試范圍)。
4. 樣品混合要充分,否則吸光值太低,甚至出現負值;混合液不能存在氣泡,空白液無懸浮物,否則讀數漂移劇烈。樣品混合不均勻會直接導致檢測不確定,重復性低。
5. 樣品檢測上樣量不能太少,必須能夠保證能后連接上下兩根光纖形成光柱,從而使得檢測正常進行。
6. 樣品臺清潔,在檢測前,檢測后以及連續使用儀器30分鐘后均需要對上下接觸樣品的部位用雙蒸水或純水擦拭。
7. 切忌不可用噴壺在樣品臺上噴射,以防液體液體進入儀器內部造成損壞。
8. 切忌不可用洗滌劑或異丙醇清潔基座。
9. 儀器放置位置應當遠離通風口,以免液滴蒸發太快導致濃度讀數偏大。



 12
12
