
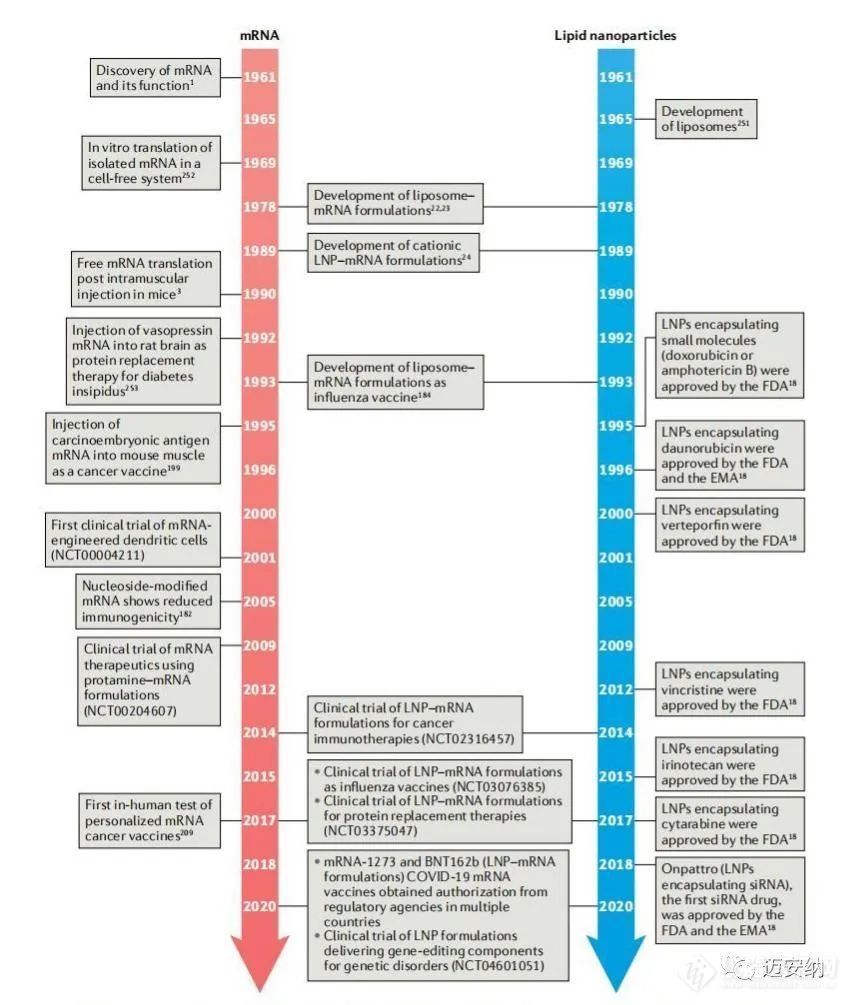
mRNA從開創性發現研究到現今為止已經過去了七十多年,mRNA分子的不穩定性和免疫原性已經被大大改善,同時在一系列的應用中都展現出了治療潛力。為了達到治療效果,mRNA分子必須達到特定的靶細胞,因此對于mRNA遞送材料是有一定要求的。
用于mRNA傳遞的脂質的發展
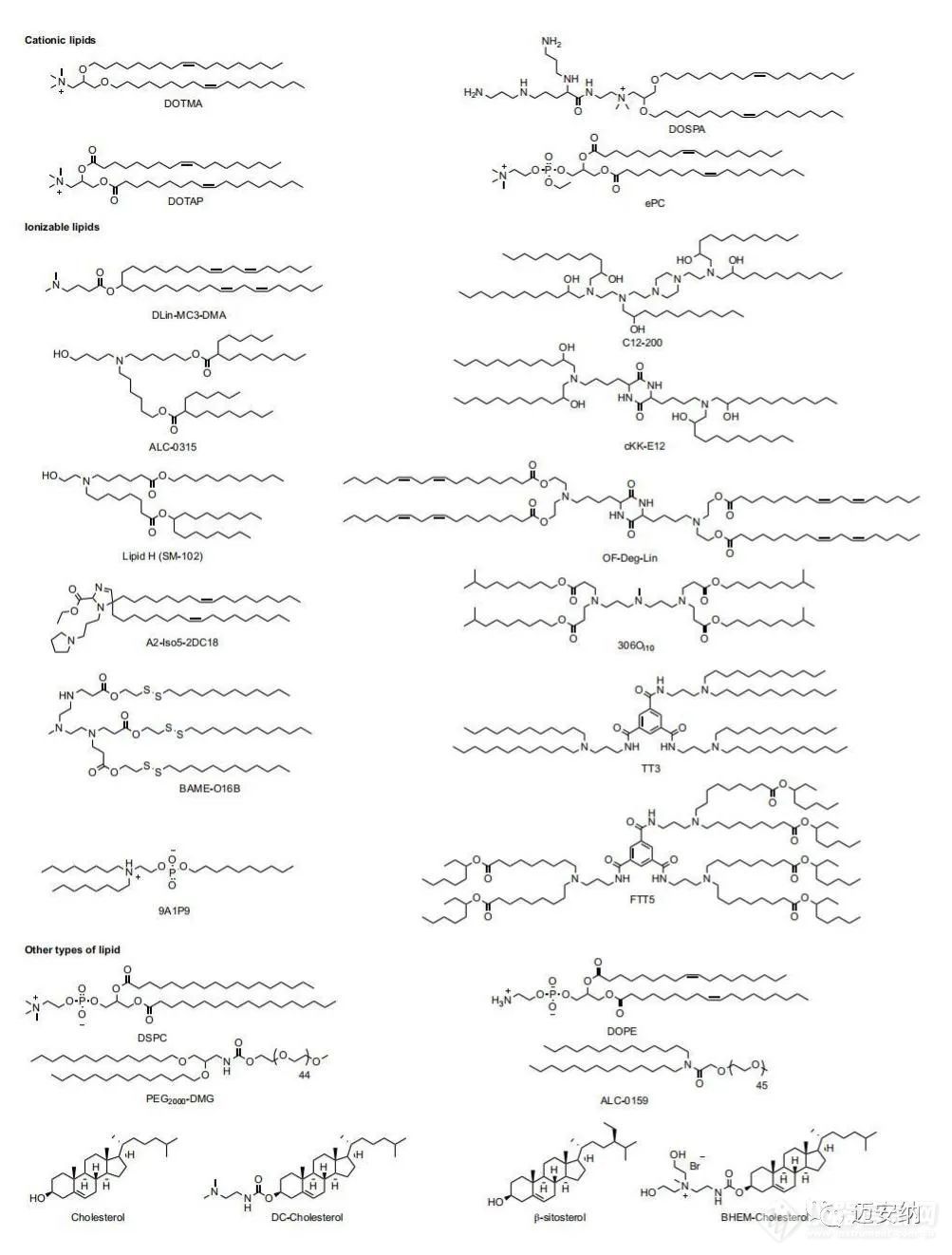
脂質是一種兩親性分子,包含三個結構域:一個極性頭基,一個疏水尾部區域和一個連接體。已被研究用于mRNA遞送的脂質包括陽離子脂質、可電離脂質及其他一些類型的脂質。
用于mRNA傳遞的脂質的發展
陽離子脂質
陽離子脂質是被研究探索商業化較多的脂質,例如基于epc的脂質納米顆粒已被應用于mRNA的腫瘤免疫治療;基于DOTAP的陽離子納米乳劑可以遞送抗病毒、細菌和寄生蟲感染藥物;DOTAP-聚合物混合納米顆粒可以傳遞mRNA分子用于治療腫瘤疾病,傳染病和遺傳疾病。另外在DOTAP脂質納米顆粒中加入碳酸鹽脂灰石,通過將纖維連接蛋白結合到脂質納米顆粒上,可以進一步提高傳遞效率,這種細胞粘附蛋白的方式可以加速細胞內吞速率。
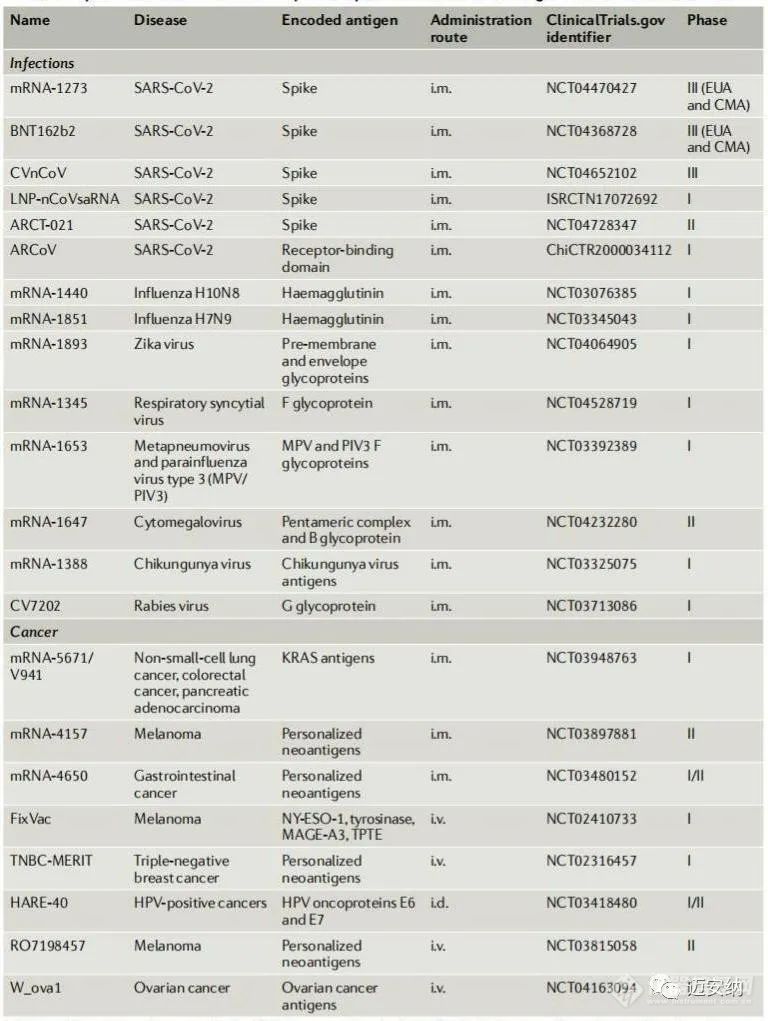
LNP-mRNA疫苗抗感染和癌癥的代表性臨床試驗
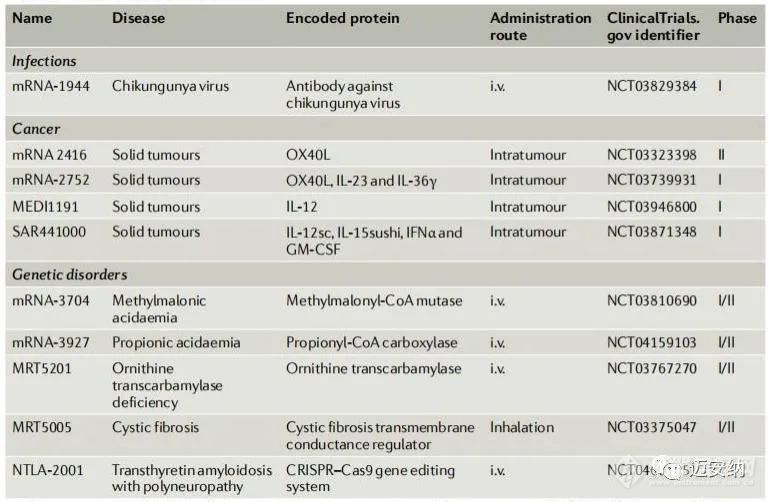
LNP-mRNA治療感染、癌癥和遺傳性疾病的代表性臨床試驗
可電離脂質
另一種應用較多的脂質是可電離脂質。在低pH值下會被質子化,這使它們帶正電荷,但它們在生理pH值上保持中性。可電離脂質的pH值敏感性有利于體內mRNA的傳遞,因為中性脂質與血細胞陰離子膜的相互作用較少,從而提高了脂質納米顆粒的生物相容性,攜帶正電荷利于納米顆粒從內體中逃逸。除了陽離子或可電離的脂質外,LNP-mRNA配方還包含其他脂質成分,如磷脂(如磷脂酰膽堿和磷脂酰乙醇胺)、膽固醇或聚乙二醇(PEG)功能化的脂質(PEG-脂質)。這些脂質可以提高納米顆粒的性質,如顆粒的穩定性、傳遞效率、耐受性和生物分布。
LNP-mRNA配方需要克服多個阻礙才能實現體內有效表達。包括:2、配方在全身給藥后應逃避MPS的攔截和腎小球濾過的清除。3、LNP-mRNA系統需要到達靶組織,然后由靶細胞內化。之后mRNA分子必須逃離內含體到達細胞質,在那里發生翻譯。
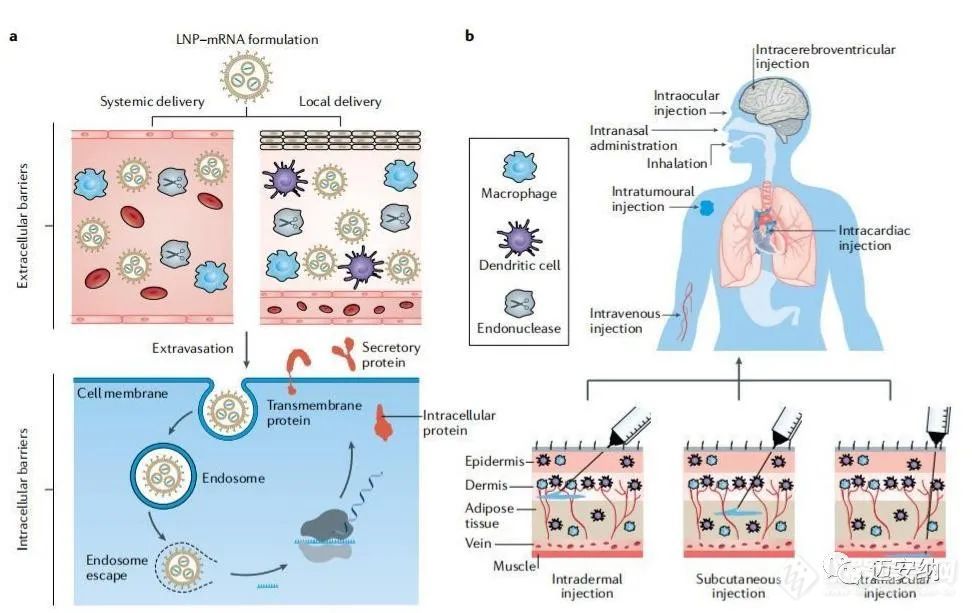
a為LNP-mRNA配方在遞送過程中的障礙;b為LNP-mRNA的給藥途徑給藥途徑會影響LNP-mRNA配方的器官分布和治療結果等多個方面。給藥途徑通常取決于納米顆粒的性質和治療適應癥。在靜脈注射給藥后,許多脂質納米顆粒可以在肝臟中積累,這可能會增加對mRNA疫苗的免疫反應。例如,靜脈注射使用mRNA疫苗已被證明可誘導出更強的抗原特異性細胞毒性T細胞球。研究表明,LNP-mRNA疫苗可在耐受性良好時產生強大的免疫反應。另外疫苗接種也可以通過鼻內給藥來完成,因為外周淋巴結中的APCs可以很容易地接納藥物配方。LNP-mRNA配方需要根據疫苗和作為治療藥物的不同特性制作來達到期望的治療效果。主要需要考量的問題在于:1、GMP生產;2、穩定性和存儲;3、安全性。
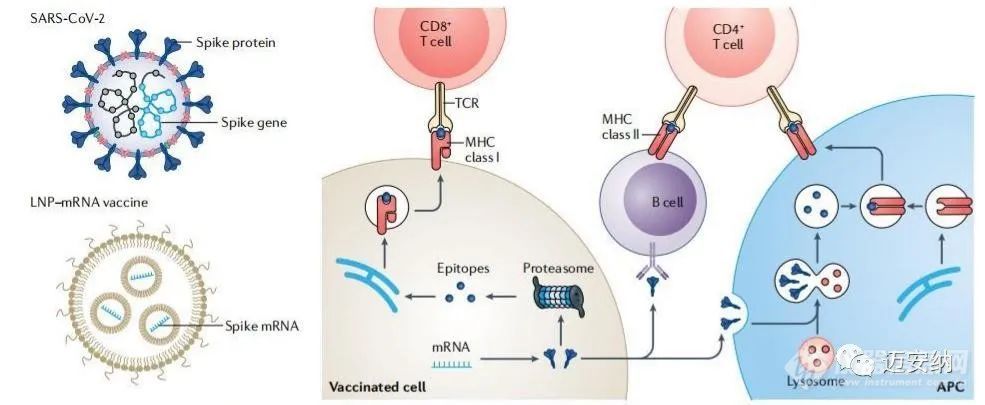
mRNA技術和基于脂質納米顆粒遞送系統的發展已成為對抗COVID-19的強大工具。根據臨床研究的經驗教訓,LNP-mRNA配方可以被繼續改良。通過RNA工程可以進一步提高mRNA分子的體內翻譯效率。此外,具有電荷改變功能的可釋放轉運體和修飾的樹狀大分子可以在體內外有效地傳遞mRNA分子。天然來源的外泌體和細胞膜也可以應用于mRNA的遞送。不同器官和細胞的遞送可以通過調節脂質結構來實現。脂質納米顆粒的設計還應考慮其生物降解性和多功能性。生物可降解的脂質能夠從血漿和組織中快速清除脂質納米顆粒,提高其安全性和耐受性。
總之,mRNA在許多臨床試驗和臨床應用中都顯示出了巨大的治療潛力。下一代脂質納米顆粒和其他類型的遞送材料的發展將進一步使基于mRNA的治療廣泛的疾病成為可能,在未來擁有更加廣闊的道路。
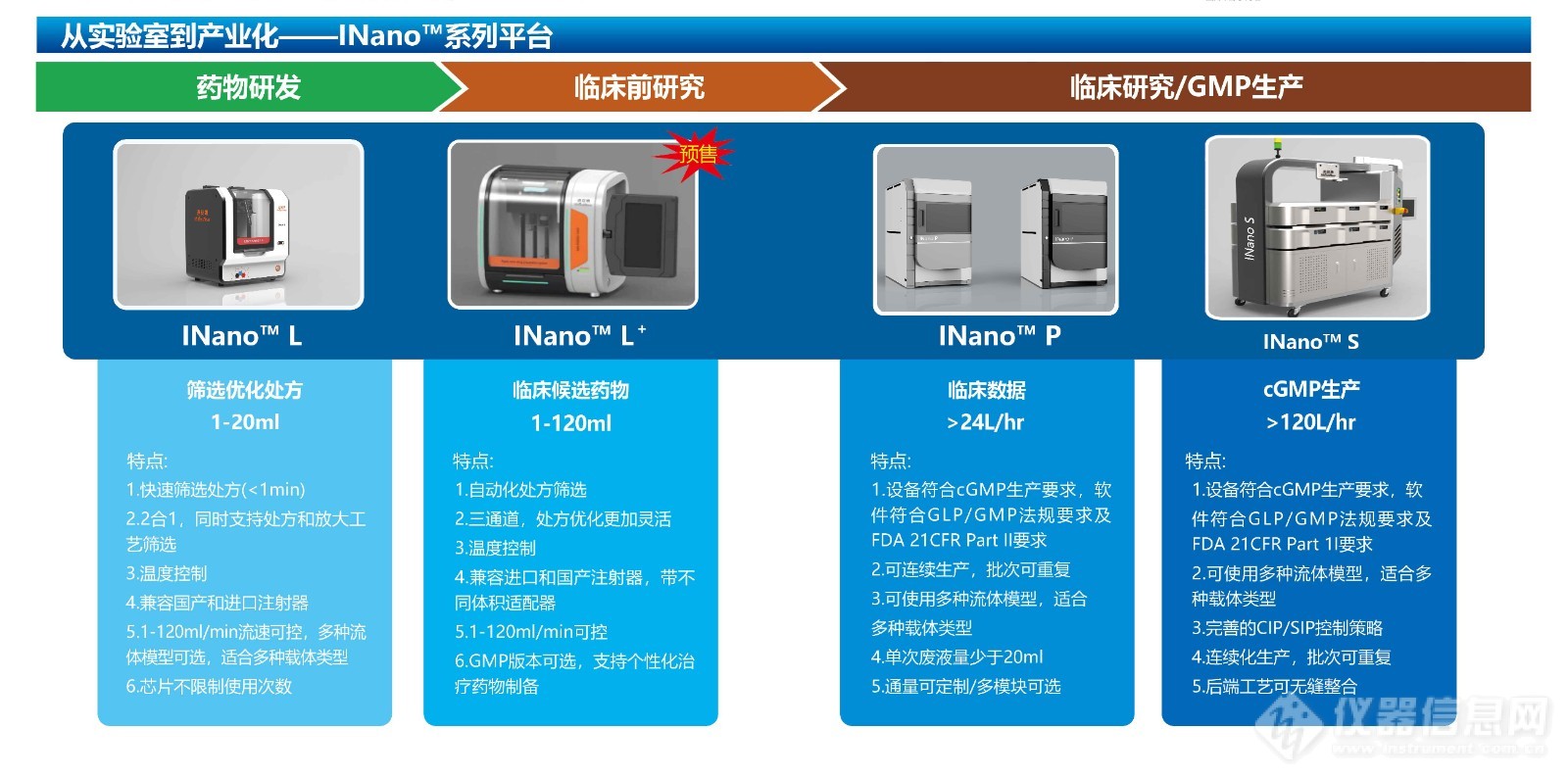
INano™快速納米藥物制備系統
關注我們的公眾號了解更多↓↓↓↓









