大鼠原代細胞分離與培養
一、大鼠神經元細胞(酶消化法)
簡述:新生24h或E18胎鼠,取腦,剝離海馬,剪碎,木瓜酶消化,清洗過篩后鋪于多聚賴氨酸包被的培養板中。

二、大鼠雪旺細胞(植塊法)
簡述:新生24h大鼠,取坐骨神經,剝去外膜和束膜,剪成1mm3的小塊,均勻鋪于培養皿內,加少量血清,37℃ CO2培養2h后,再加入培養基,24-48h后有細胞爬出。
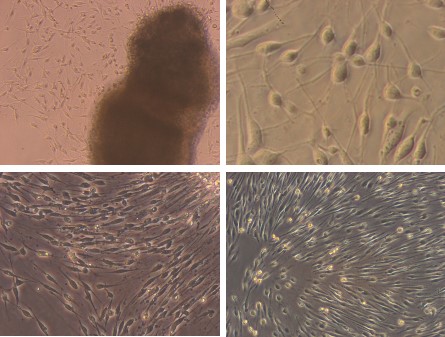
三、大鼠胰島(酶消化加密度梯度離心)
簡述:SD大鼠,常規麻醉、固定、消毒、進腹、膽總管插管,逆行注入預冷的1mg/ml膠原酶P溶液10ml。迅速取下胰腺,38℃水浴消化10分鐘,600μm不銹鋼網過濾,加入4℃新生牛血清和4℃Hank’s液終止消化。細胞懸液離心后,4℃ Hank’s液洗滌兩次。沉淀物加25%Ficoll混勻,其上依次分別加入23%、20%、11%Ficoll溶液和Hank’s液,離心后吸出23%-20% 及20%-11%界面的胰島,用4℃Hank’s液洗滌離心共三次。
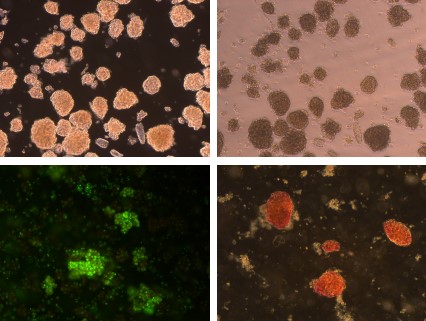
四、大鼠心臟竇房結細胞(酶消化法)
簡述:大鼠心臟竇房結位于上腔靜脈靠近右心房處的內壁上;取出生2-3day的新生大鼠,75%酒精浸泡后,固定于解剖板上,開胸,顯微剪分離出上腔靜脈及右心房一部,至于冷的HANKS緩沖液中,于解剖鏡下觀察搏動點,并剪去多余部分;之后將幾只鼠的竇房結集中,剪碎后用0.5mg/ml II型膠原酶37℃消化20-30分鐘,期間吹打數次,可分部收集消化下來的細胞。收集到的細胞加入10倍體積的PBS,1000rpm離心5分鐘,棄上清,重復清洗一遍,沉淀中加入15%FBS的高糖DMEM培養基,重懸細胞,鋪板,37℃,5%CO2 培養90分鐘后,將未貼壁的細胞轉移至新的培養皿中,繼續培養,每天換液一次。
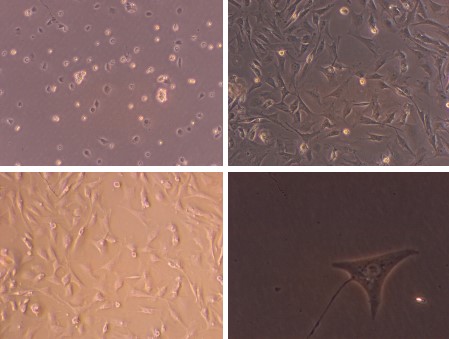
五、大鼠關節滑膜間質細胞(酶消化法)
簡述:大鼠麻醉后,75%酒精消毒術區,于雙側膝關節關節腔取出滑膜組織,浸泡于含1%鏈霉素和青霉素的雙抗H-DMEM中,低溫下轉移至超凈工作臺。使用含1 %雙抗的PBS沖洗滑膜組織3次,用眼科剪將其剪成約1 mm×1 mm大小的組織塊。加入10倍體積的0.4% Ⅰ型膠原酶,于37 ℃,體積分數5%CO2飽和濕度條件下進行4 h消化,待絮狀物大部分消失后,100μm細胞篩過濾,吸取濾過液,1 200 r/min離心5 min,棄上清液,無菌PBS洗滌3次,用含體積分數10%胎牛血清的H-DMEM高糖培養基(含200 mmol/L谷氨酰胺,100 μmol/L抗壞血酸,100 U/mL青霉素,100 mg/L鏈霉素),以2×106/孔的細胞濃度接種于六孔板中,置37 ℃,體積分數5%CO2培養箱中培養。
 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 7
7