過去,中樞神經系統(CNS)藥物研究主要依賴于嚙齒動物模型或細胞體外模型等傳統方法。由于人類和嚙齒類動物間的物種差異,所獲得的數據難以真實地模擬神經發育和疾病機制等。隨著干細胞技術的發展,培養人大腦類器官成為目前神經科學研究領域炙手可熱的研究項目。大腦類器官是模擬人腦的生理特性的*的工具,可用于研究正常腦與疾病腦的建模,用于闡明中樞神經系統疾病的發病機制,亦可用于神經發育疾病的探索,或用作中樞神經系統藥物篩選的工具。
|
| 01 |腦類器官培養方法概述 |
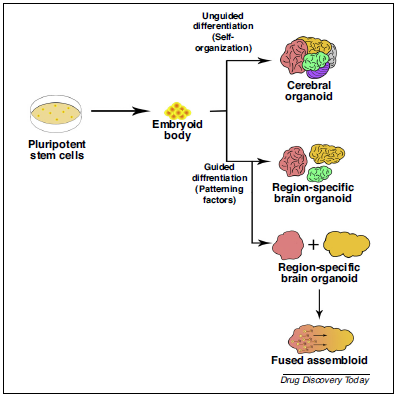
腦類器官通常從人多能性干細胞(ESCs/iPSCs)開始培養,自發形成腦發育早期所具備的結構和層次。但腦細胞團簇達到一定尺寸后,可發育的階段會受到營養缺乏和氧供應的限制,繼而神經元開始死亡,結構停止發育。 目前,大腦類器官的培養主要分為兩種方法,引導分化法 (Guided)和非引導 (Un-guided)分化法。 ①非引導分化法依賴于細胞自身的形態發生和內在的分化能力,將外在干擾小化,得到的類器官有前腦、中腦、后腦、視網膜和脈絡叢等多種細胞譜系,該種方法的缺陷在于高可變性和異質性。 ②而引導分化法是加入一些外源性的模式因子,誘導hPSCs分化為想要的細胞譜系。 在類器官結構中,多能性干細胞(ESCs/iPSCs)誘導為擬胚體 (Embryoid Body, EB),在外胚層形成后,引導分化為神經或非神經方向。引導分化法獲得的類器官依賴分化過程中添加的生長因子,大多數是腦區特異性的,如皮層、海馬、中腦、大腦等。引導分化法得到的類器官含有神經祖細胞、神經元、星形膠質細胞及其他的大腦細胞。由于是引導性分化,批次間的可變因素少,可以產生對應比例的特異性細胞類型。很多團隊都在嘗試用不同的方法來培養類器官,分別培養腦區特異的類器官后再將其共培養,類器官會自我融合形成含有不同腦區的類器官,該模型可以用于研究腦區間的相互作用。 |
 |
| |
| 02 |3D大腦類器官的制作方法 |
| |
2013年,Lacaster和Knoblich等發表在Nature及Nature protocol上的3D大腦類器官的制作方法使得體外用人多能干細胞 (包括胚胎干細胞及誘導多能干細胞)誘導3D大腦類器官的技術前進了一大步,他們通過使用一種允許類器官獲取能量和氧氣的新方法克服了這一局限,使用一個微小的振動刀片將類器官切成半毫米切片,然后將它們放在覆蓋富含營養的液體的多孔膜上。然后,類器官可同時從上方吸收氧氣,從下方吸收營養物質,使其在培養物中繼續發育一年。圖1是該方法的概括。
 |
| |
| 03 |文獻分享 |
| |
以下介紹了2014年,Lancaster發表在Nature Protocol上的“Generation of cerebral organoids from human pluripotent stem cells”一文中從人多能性干細胞(iPSCs/ESCs)誘導腦類器官的方法:
|

|
誘導EB形成 1-2h | 1. 當ESCs/iPSCs在六孔板中長到融合度為70-80%時用于誘導EB,通常每個六孔板孔的細胞可用于誘導一整個96孔板。
注:干細胞克隆的形態對于大腦組織形成的成功與否非常關鍵。克隆需呈現多能性的特征 (如邊緣清晰,克隆緊密等),且無分化傾向;
對于無飼養層培養的ESCs/iPSCs:
① 用1ml的無鈣鎂的D-PBS洗滌細胞后,向每孔中加入600μl的含0.5mM的EDTA的無鈣鎂的D-PBS溶液。培養箱孵育4min;
② 輕柔吸出EDTA溶液,注意不要破壞克隆,加入1ml的Accutase。放回培養箱孵育4min;
③ 用1ml的mTeSR1培養基吹散克隆,使其從培養皿底部脫落。轉移2ml至15ml離心管中,用1ml移液器將克隆吹散為渾濁的單細胞懸液;
④ 270g 室溫離心細胞5min,同時用臺盼藍檢測死細胞,用血細胞儀或自動細胞計數儀細胞計數;檢測兩次取平均值;
⑤ 用1ml的含50μM的ROCK抑制劑Y-27632的低bFGF的ESCs培養基重懸細胞,吹打,保證細胞呈單細胞重懸的狀態。然后,用含Y-7632的低FGF-2的培養基重懸細胞,使細胞濃度為每150μl含9000個活細胞;
⑥ 每個96孔板孔中放入150μl的細胞懸液,置于培養箱繼續培養; | 飼養EB,早期胚層分化 5-7d | 2. 24h后,顯微鏡下觀察,可見有清晰邊緣的小的EB形成,邊緣有許多死細胞圍繞在EB周圍,為正常現象,不會干擾EB在中間形成,繼續置于37℃的5%二氧化碳的培養箱中培養;
3. 隔天輕柔地吸去半量培養基,避免干擾到EB和底部的細胞,補充150μl的新鮮培養基(總體積會大于150μl,量的準確與否不重),培養基中添加Y-27632(1:100),FGF-2濃度為4ng/ml,直到EB直徑大于350-450μm為止,通常,僅前4天需要添加二者;
4. EB直徑達到350-600μm時,用3中的培養基隔天飼養EB,培養基中不含Y-27632和FGF-2; | 原始神經上皮的誘導 4-5d | 5. EB直徑達到500-600μm時,邊緣開始變得明亮,并且呈現光滑的邊緣 (通常為第6天),將每個EB用剪掉槍頭的200μl移液器轉移至含有500μl的神經誘導培養基的低吸附24孔板中,輕柔且不要破壞EB,繼續培養; 注:將200μl移液器槍頭剪掉,使開口直徑約為1-1.5mm。確保開口不要太小,避免破壞EB,但也不能太大,太大會難以吸去EB。不要試圖用刮刀將EB鏟出,會破壞EB的結構;
6. 轉移至24孔板后,另外加入500μl的神經誘導培養基飼養EB;
7. 2d后,組織培養顯微鏡觀察EBs,形態邊緣變得更加明亮,提示神經外胚層的分化;一旦這些區域開始顯示與神經上皮形成一致的假復層上皮的放射狀組織,這一般發生在神經誘導培養基中的4-5d后,繼續進行第8步,將組織聚集轉移到Matrigel液滴中;
注:健康的細胞聚集有光滑的邊緣,神經上皮邊緣在光學上呈半透明狀。有時組織可能在光學上表現為非放射狀組織的半透明組織,雖然這不是理想狀態,但沒有觀察到這對類器官形成有長期的負面影響。重要的是,如果在神經誘導中再多放置1-2天,這些非放射區域就會變成放射狀,但是如果不及時轉移到基質凝膠(步驟8),其他已經放射狀的區域可能開始收縮并失去形成神經上皮芽的能力。當有神經外胚層出現時,需盡快將組織轉移到Matrigel中,如果太晚,會影響腦組織的晚期形態; | 將神經外胚層組織轉移至Matrigel液滴中 1-2h | 8. 4℃下冰上解凍Matrigel。觀察發現,500μl的Matrigel在冰水混合物浴時,1-2h后會恢復液體狀態; 9. 將Parafilm膜置于一個空的帶有凹坑的中號槍頭盒上,將手指按向Parafilm膜形成凹坑,每個坑的體積約為200μl;
注:Parafilm不能高壓滅菌,所以不能*滅菌,因此需保證Parafilm膜保存在干凈的環境中,準備凹坑前,向手套和Parafilm膜噴灑70%乙醇消毒;在這一步也可以在培養基中添加抗生素以避免污染;
10. 將Parafilm膜用剪刀修剪為單個含4x4(共16個)凹坑大小的正方形,將其放入60mm的組織培養皿中;
11. 用200μl的移液器轉移神經外胚層組織,每個凹坑中放置1個;
注:將200μl移液器槍頭剪掉,使開口直徑約為1.5-2mm。確保開口不要太小,避免破壞EB,但也不能太大,太大會難以吸去EB。不要試圖用刮刀將EB鏟出,會破壞EB的結構;
12. 用未剪頭部的200μl移液器小心地吸去組織邊緣多余的培養基;
13. 每個組織快速滴入Matrigel,每孔約30μl,使Matrigel滴入Parafilm凹坑中;
注:快速滴入Matrigel,避免組織干掉。盡量一次性滴入Matrigel,一次性包埋好16個組織;
14. 用10μl的移液槍頭移動組織,使組織位于液滴的中央,這一步需要在滴入Matrigel后立即進行,因為室溫下Matrigel非常容易固化;
15. 將此60mm培養皿置入37℃培養箱中,孵育20-30min以使Matrigel聚合;
16. 取出60mm培養皿,加入5ml不含Vitamin A的腦類器官分化培養基;
17.將Parafilm膜反過來并搖動培養皿,直至Matrigel液滴從凹坑中滴入培養基中;不容易脫落的液滴可以用鑷子用力晃動Parafilm膜使其脫落,將培養皿置于培養箱中繼續培養組織。 | 神經上皮芽的固定培養 4d | 18. 24h后,觀察包埋的組織,1-3d內,組織會呈現包含液體空腔的進一步擴張的神經上皮樣; 注:從Matrigel主體中會遷移出一些細胞類型,通常呈成纖維細胞樣,這些細胞代表了非神經特性的群體,從神經誘導時逃脫出來;然而這些細胞通常不能生存,且遷移出來后,對神經上皮芽的形成呈現促進作用;
19. 將液滴繼續培養24h,然后將培養基更換為不含Vitamin A的腦類器官分化培養基,繼續培養48h;
注:換液時,傾斜培養皿使液滴下沉,輕柔吸出培養液。盡量在不破壞類器官的情況下,吸出更多的培養液。更換為5ml的新鮮培養液; | 腦組織的生長 ~1年 | 20. 4h的靜止培養后,用開口約為3mm的剪去頭部的1ml移液槍頭將包埋好的類器官轉移至125ml的震動反應器中,加入75~100ml的含Vitamin A的腦類器官分化培養液,將此生物反應器放置在培養箱中安裝的磁攪拌板或軌道振動篩上用85rpm的速度震動。也可以將60mm的培養皿中培養液更換為含Vitamin A的腦類器官培養液,將其置于軌道振動篩上培養; 注:每個生物反應器中不要轉移超過2個60mm培養皿的類器官(32個),太多類器官會引起類器官的融合;
使用低速攪拌攪拌板,因為常規速度的攪拌棒會因磁力攪拌而引起發熱;
軌道振動篩可用于分析多種培養條件,同時使用多種基因突變劑處理,而傳統的攪拌板只能同時防止4-6個單獨的瓶;用生物反應器和軌道振動篩培養的腦類器官未觀測到有區別;
21. 振動篩上的類器官每3-4天全量換液,搖瓶上的類器官每周換液,注意觀察形態;在合適的時間點取樣本用于實驗研究; |
|
| |
PeproTech提供人腦類器官培養所需的各種細胞因子及小分子,并提供人ESC/iPSCs培養所需的培養基及培養器皿包被基質,產品詳情如下表:
|
| |
| 04 |參考文獻 |
1.Chhibber T et al.(2020). CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today Feb;25(2):456-465. 2.Lancaster, M.A. et al. (2013) Cerebral organoids model human brain development and microcephaly. Nature 501, 373-379 3.Lancaster, M.A. and Knoblich, J.A. (2014) Generation of cerebral organoids from human pluripotent stem cells. Nat. Protoc. 9, 2329-2340. |



 您好, 歡迎來到化工儀器網
您好, 歡迎來到化工儀器網

 7
7